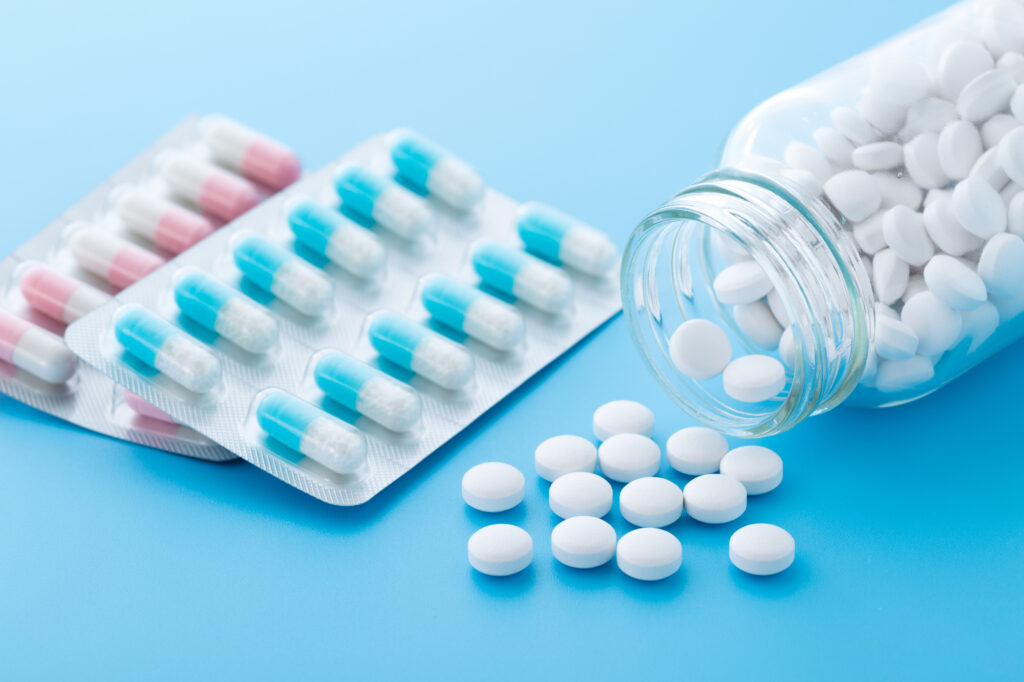
日本製薬団体連合会(日薬連)は11月21日、ジェネリック医薬品(後発薬)を扱う全172社が実施した製造実態に関する自主点検の結果を公表し、8734品目中、4割強に当たる3796品目で製造販売承認書と異なる製造があったことが明らかになった。厚生労働省の会議で速報値として報告された結果によると、品質や安全性に影響はないとした。
背景には、急激な需要増加に対応できない生産体制や品質管理の不備がある。政府は医療費抑制の有効な手段として後発医薬品の使用促進を掲げ、2017年6月、後発医薬品の使用割合を80%とし、2020年9月までに達成させるという具体的な目標が設定された。しかし一方で、市場が急拡大し、メーカー間の競争激化と薬価下落の悪循環に陥ったことが指摘されている。
今回の自主点検は、2021年に実施された業界団体(JGA)による点検以降も品質不適切事案が発生していることを受けて行われ、今回、新たに自主点検実施範囲を拡大し、不適切事案に基づく項目を追加するなどの内容を盛り込んで行われた。
点検では書類確認や従業員のヒアリングが行われ、製造販売承認書と異なる方法で原材料を混合したり、品質試験を行ったりといった事例が判明。承認書の誤記も確認されている。













 ご友人は無料で閲覧できます
ご友人は無料で閲覧できます Line
Line Telegram
Telegram










ご利用上の不明点は ヘルプセンター にお問い合わせください。