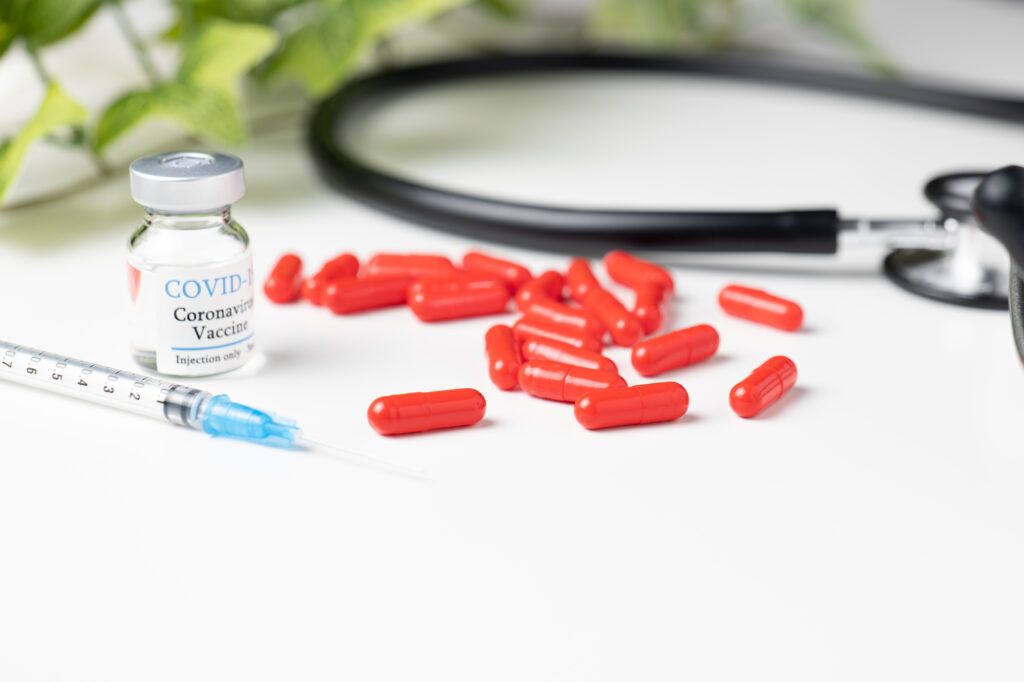
厚生労働省は24日付で、新型コロナウイルス感染症経口治療薬「ラゲブリオ」(モルヌピラビル)について、投与開始前の「同意書の取得」を不要とする処方上の変更を行った。EUの保険当局は、ラゲブリオは十分な治療効果が得られなかった事を理由に販売を認めないよう勧告している。
同意書の取得が不必要になった理由
厚生労働省の医薬・生活衛生局の医薬品審査管理課と医薬安全対策課は24日付で、新型コロナウイルス感染症経口治療薬「ラゲブリオカプセル200mg」(モルヌピラビル)について、投与開始前の「同意書の取得」を不要とする処方上の変更を行った。
不要とされた理由について、製造元のMSD製薬は、特例承認時に提出が猶予されていた資料の評価が完了していなかったが、資料が提出され、当局による評価が完了したとしている。承認後、胎児に影響が出るおそれがあるとして、妊婦や妊娠している可能性がある女性は服用しないこととしていた点については保留されている。
特例承認とは、外国で既にその疾患の治療に用いられていることを条件に、厚生労働大臣が通常の承認の要件を満たさない場合でも承認が可能となる制度だ。
2021年12月3日に申請され、同月24日に特例承認されたラゲブリオは米国の製薬大手メルクが開発した新型コロナの治療薬で、重症化リスク因子がある患者の入院や死亡のリスクをおよそ30%低下させる効果があるとされていた。
ラゲブリオに添付された文章には、この治療薬が特例承認されたもので、承認時において有効性、安全性、品質に係る情報を収集中であると記されており、使用に当たっては、あらかじめ患者又は代諾者に、特例承認された薬剤である事や有効性及び安全性に関する情報を十分に説明し、文書による同意を得てから投与するよう求めていた。今回の変更により、投与開始前の同意書取得が不要となる。
EUの保険当局 販売承認を拒否することを推奨
しかし欧州連合(EU)の医薬品規制当局、欧州医薬品庁(EMA)は今年2月25日、抗ウイルス薬モルヌピラビル(商品名:ラゲブリオ)について、十分な治療効果が得られない事を理由として、新型コロナウイルスの治療薬としての販売を認めないよう勧告している。
MSD製薬から提供されたデータを評価し、EMAの医薬品委員会 (CHMP ) は、ラゲブリオが入院または死亡のリスクを軽減したり、重篤な疾患のリスクがある成人の病気の期間や回復までの時間を短縮したりできると結論付けることはできないと示した。
またCOVID-19の治療において、副反応服用による効果と副反応などの健康被害といったリスクのバランスを確立できず、販売承認を拒否することを推奨している。
服用後死亡者は128人
医薬品の副反応の症例を収集し評価している厚生労働省所轄の独立行政法人PDMAのサイトの副作用疑い報告では、承認後2年足らずで重篤者572人(5月3日時点)、死亡者の数が128人となっている。













 ご友人は無料で閲覧できます
ご友人は無料で閲覧できます Line
Line Telegram
Telegram









ご利用上の不明点は ヘルプセンター にお問い合わせください。