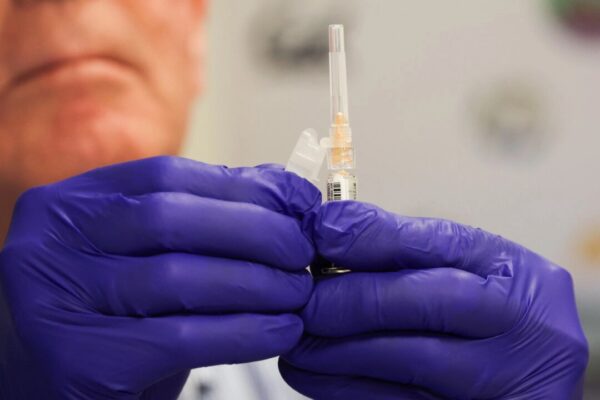
米保健福祉省(HHS)のロバート・F・ケネディ・ジュニア長官は8月5日、mRNAワクチンの開発に関する22の契約を中止し、資金を別のワクチン開発に振り向けると発表した。理由は「mRNAワクチンが新型コロナウイルスやインフルエンザなどの上気道感染症に対して効果的に機能しないことがデータで示されたため」としている。
このmRNAワクチン開発事業は、HHS傘下の生物医学先端研究開発局(BARDA)が主導し、グローバル・ヘルス・インベストメント・コーポレーション(GHIC)が管理。22件の契約の総額は約5億ドルにのぼるという。
HHSの発表によると、この決定は「COVID-19の公衆衛生緊急事態中に開始されたmRNA関連投資の包括的な見直し」を受けてのもの。ケネディ氏は「科学を検証し、専門家の意見を聞いたうえで判断した。後は、変異するウイルスに対しても有効性を維持できる、より安全で汎用性の高いワクチンプラットフォームへの投資へとシフトする」と述べた。
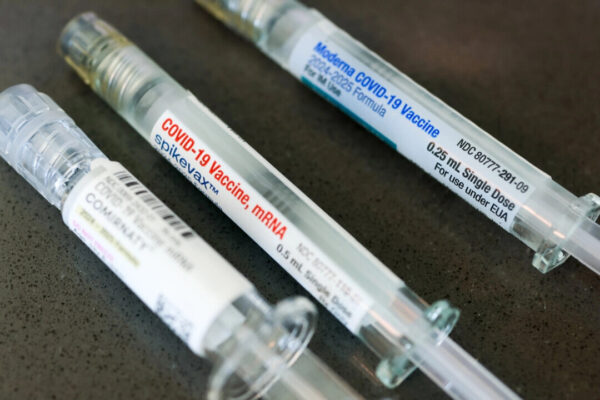
中止対象には、モデルナ社とテキサス大学医学部のへのH5N1型インフルエンザ用mRNAワクチン開発支援が含まれる。また、ファイザー、サノフィ・パスツール、CSLセキラス、グリットストーンなどから提出された契約前提の提案も取り下げまたは却下される。
既存の3契約でmRNA関連業務を縮小し国防総省との協力体制の見直しも実施される。これにより、AAHI社、アストラゼネカ社、HDT Bio社との核酸ワクチン開発も影響を受ける見込みだという。
プレスリリースでは、最終段階にある一部の契約は継続されるものの、今後新たなmRNAベースのプロジェクトは立ち上げられないと明言されている。
ケネディ氏は「明確にしておきたい。HHSは、ワクチンを望むすべてのアメリカ人のために、安全で効果的なワクチンを支持している。そのため、mRNAの限界を超え、より優れた解決策への投資を進めている」と強調した。
今回の発表は連邦政府のワクチン開発政策における大きな転換点を示しており、今後BARDAはより安全性が高く、臨床・製造データの透明性が確保されたプラットフォームに注力していくという。
HHSは「緊急対応期に資金提供された技術のうち、現在の科学的基準を満たさないものは段階的に廃止され、今後は、全粒子ワクチンや新しいプラットフォームなど、エビデンスに基づき倫理的に正当化された手法が優先される」と説明。
ケネディ氏はHHS長官就任以来、ワクチン政策で複数の変更を実施。5月下旬、食品医薬品局(FDA)は今後のコロナワクチンの対象を65歳以上や基礎疾患のある人に限定する方針を発表。また、ワクチン製造企業に対し、子供や健康な若年成人でのワクチン効果と安全性の詳細な研究を許可した。
最近、HHSは疾病対策センター(CDC)のワクチン諮問委員会の17人全員を解任。妊婦や健康な子供へのコロナワクチン推奨を終了し、インフルエンザワクチンから水銀の除去を指示した。
8月1日には、病院のスタッフワクチン接種率報告を報酬に連動させる連邦政策を廃止。2021年8月に導入されたこの政策は、医療機関の入院患者支払いルールに基づいていた。













 ご友人は無料で閲覧できます
ご友人は無料で閲覧できます Line
Line Telegram
Telegram









ご利用上の不明点は ヘルプセンター にお問い合わせください。